Accueil Arborescence Page précédente
|
Modèle de Chadwick
La petite histoire Comprendre simplement Domaines de présence Son interprétation dans l'avenir Les références Mais encore … |
|
by Pepe © Accueil Arborescence Page précédente |

|
|
La petite histoire Up Page Les isotopes (1919) En 1919, la découverte des isotopes avait amené Rutherford à prédire que le noyau devait contenir des particules neutres. De plus, des physiciens avaient découvert un rayon très pénétrant en bombardant le béryllium avec des particules alpha. Toutefois, ce rayon était impossible à détecter directement. |
|
Comprendre simplement Up Page Le neutron (1932) En 1932, le physicien anglais James Chadwick, élève de Rutherford, prouve que ces rayons pénétrants non identifiés par les physiciens contiennent une particule dépourvue de charge électrique et de masse égale à celle du proton. Il la nomme neutron. En 1936, le Danois Niels Bohr représentait le noyau comme une goutte à l’intérieur de laquelle protons et neutrons, indiscernables, s’agitaient de façon chaotique, comme des molécules dans une goutte liquide. |
|
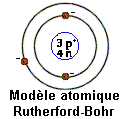
Domaines de présence Up Page Monde présent Ce sont donc les neutrons qui empêchent l'éclatement du noyau et qui le conservent stable! Cette découverte permettra la production d'une variété de nouveaux radio-isotopes et entraînera les réactions nucléaires en chaînes. Elle mènera directement à la fission nucléaire et à la bombe atomique. De 1943 à 1945, Chadwick fera de nombreuses recherches sur le développement de la bombe atomique. Il participera aussi au Projet Manhattan. Le modèle atomique de Rutherford modifié par Bohr et amélioré par Chadwick se nomme le modèle atomique de Rutherford-Bohr. Il est encore en vigueur aujourd'hui et on l'appelle aussi modèle atomique actuel simplifié. Il présente l'atome comme une unité divisible comportant des particules positives (protons) et des particules neutres (neutrons), concentrées dans un noyau minuscule et dense, et des particules négatives (électrons) évoluant sur des couches électroniques. |
|
Son interprétation dans l'avenir Up Page Théorie moderne Malgré le succès remporté par le modèle de Rutherford-Bohr, il sera impossible de développer une théorie générale de tous les phénomènes atomiques en se basant sur la mécanique quantique. Erwin Schrödinger partira de l'idée fondamentale de Louis de Broglie d'associer une onde à tout corpuscule pour élaborer les principes de la mécanique ondulatoire. La position, la vitesse et la direction d'un électron ne pouvant pas être définies, on déterminera la probabilité qu'il a de se trouver dans un certain volume de l'espace situé autour du noyau, et que l'on appellera masse électronique. Cette probabilité de présence de l'électron, ou densité électronique, est déterminée en recherchant la fonction qui satisfait une équation aux dérivées partielles du second degré, proposé par Schrödinger. De plus, plusieurs chercheurs ont apporté des modifications au modèle atomique, de sorte que le modèle de Rutherford-Bohr est maintenant extrêmement raffiné. |
|
Les références Up Page Réseau Pepe Source Pourquoi ce site Je crois que, si les êtres humains que nous sommes ne parviennent pas toujours à évoluer comme ils le souhaiteraient _à s'épanouir professionnellement, sentimentalement et sexuellement (ce que j'appelle les trois pôles d'intérêts) c'est parce qu'il y a des barrages qui entravent leur désir d'accéder à un rêve inachevé. Je pars du principe que tout est possible, à condition de s'entourer de gens qui nous poussent à croire en nous. Contribuer au Réseau Pepe Ce site est avant tout une encyclopédie ouverte à l'imagination et au savoir, où chacun(e) d'entre vous peut participer. Si vous avez envie de partager une passion, ou si vous sentez le besoin de vous exprimer sur un point précis, je vous invite à m'adresser un e-mail (adresse électronique accessible sur ma page d'accueil). |
|
Mais encore … Up Page Ce que vous avez toujours voulu savoir |