Accueil Arborescence Page précédente

|
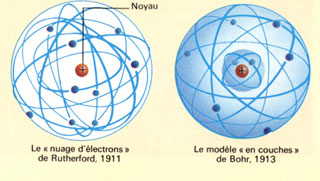
Modéle atomique de Rutherford
Energie quantifiée Plein d'espace vide Réactions nucléaires Modèle achevé Les références Mais encore … |
|
by Pepe © Accueil Arborescence Page précédente |


|
|
La petite histoire Up Page Energie quantifiée "C'était comme si, en tirant un boulet de canon sur une feuille de papier, il m'était revenu en pleine figure !". L'homme qui s'étonne ainsi s'appelle Ernst Rutherford (1871-1937). Il relate une expérience qu'il a réalisé en 1910. Ele consiste à bombarder une feuille d'or de quelques micromètres (c'est-à-dire quelques milliers d'atomes) d'épaisseur à l'aide de particules radioactives quatre fois plus massives qu'un atome d'hydrogène. Et les résultats, en effet, ont de quoi étonner: si la plupart des particules traversent la feuille d'or sans encombre, quelques-unes rebondissent violemment, comme si, au sein de l'empilement d'atomes, elles étaient tombées sur un "pépin", un obstacle compact et massif. Bohr propose, en 1912, d'ajouter au modèle planétaire une règle supplémentaire, qui impose aux électrons des orbites bien précises. Il en existe une, près du noyau, en dessous de laquelle les électrons ne peuvent circuler. Les autres orbites ont des rayons bien définis, qui se calculent à partir de l'orbite la plus basse, à l'aide des règles arithmétiques simples. Plus l'électron est loin du noyau, plus son énergie est élevée. Le modèle de Bohr stipule donc que l'énergie des électrons est "quantifiée": elle ne peut prendre que certaines valeurs bien définies correspondant à chacune des orbites autorisées. Les électrons ne peuvent changer d'orbite qu'en sautant d'un niveau d'énergie à un autre; l'atome ne peut émettre ou absorber que certaines quantités d'énergie bien précises sous forme d'ondes électromagnétiques. 
|
|
Comprendre simplement Up Page Plein d'espace vide En 1907, J.J. Thomson demande à son élève Rutherford de vérifier l'exactitude de son modèle atomique. Rutherford accepte d'approfondir la théorie du "Plum-Pudding" de Thomson et il veut étudier davantage la structure interne de l'atome. Avec l'aide de deux assistants, Hans Geiger et Ernest Marsden, il décide d'utiliser les particules alpha, très petites et très rapides, qu'il a découvertes pour bombarder une feuille d'or très mince (il utilise l'or, car ses atomes sont très lourds). Il s'attend à l'un ou l'autre de ces comportements: ou toutes les particules traversent la feuille d'or, ou aucune d'elles ne la traverse puisque la matière est homogène. Explication du montage Dans cette expérience, les particules alpha sont produites à partir d'un échantillon de radium radioactif enfermé dans une enceinte de plomb. Elles sont polarisées en un seul faisceau par une fine fente dans le bouclier de plomb. Des écrans fluorescents sont placés derrière la feuille d'or et en avant de celle-ci (en angle bien sûr, afin de ne pas freiner le passage du faisceau). Ces écrans émettent une scintillation (un point brillant) lorsqu'ils sont atteints par une particule alpha. Ils permettent donc de suivre la trajectoire des particules. En faisant l'expérience, Rutherford et ses assistants font ces observations: La plupart des particules alpha traversent la feuille d'or sans déviation comme si elles n'avaient jamais rencontré les atomes d'or (1). Plusieurs particules alpha sont légèrement déviées lors de la traversée de la feuille d'or (2). Certaines particules alpha rebondissent carrément vers la source comme si elles avaient frappé un mur (3). La déviation des particules alpha est d'autant plus importante que la masse atomique du métal composant la feuille est élevée. Ces faits vont complètement à l'encontre des attentes de Rutherford. Très surpris, il s'exclame: "C'est aussi peu croyable que si nous avions tiré un obus sur du papier de soie et que l'obus nous soit revenu en pleine figure." Rutherford en déduit que cette déviation de particules alpha positives ne peut résulter que de la présence d'un corps chargé positivement (puisqu'il y eu répulsion). De plus, puisque la majorité des particules alpha ne sont pas déviées, c'est qu'elles ne rencontrent pas de matière, donc que la majeure partie des atomes est vide 
|
|
Domaines de présence Up Page Réactions nucléaires La somme des charges des électrons est égale à la charge du noyau, l'atome étant électriquement neutre. Rutherford compare l'atome à un minuscule système solaire où des électrons (planètes) gravitent autour d'un noyau central (Soleil). En 1919, Rutherford utilisera les particules alpha pour provoquer la première désintégration artificielle de l'atome en transmuant des atomes d'azote en atome d'hydrogène. Les véritables réactions nucléaires verront ainsi le jour. Le noyau d'hydrogène produit recevra le nom de proton, particule positive du noyau. Ce proton a une masse environ 1836 fois plus élevée que celle de l'électron. Ce grand scientifique participera avec Chadwick à la fabrication de la première bombe atomique. Il s'opposera cependant au caractère secret de ce projet et redoutera les conséquences de ce développement destructeur. L'atome, l'électron et le proton sont maintenant connus. Mais il reste encore quelques mystères. En fait, ce nouveau modèle planétaire va à l'encontre des lois de la physique. Comment expliquer que les électrons puissent graviter autour du noyau positif de l'atome sans jamais s'écraser dessus? Comment se déplacent-ils autour du noyau? Quelle est leur distribution? Comment les protons chargés positivement surmontent-ils la force de répulsion électrique qui devrait normalement les éloigner les uns des autres et provoquer l'éclatement du noyau? Les réponses viendront de Niels Bohr et de James Chadwick. 
|
|
Son interprétation dans l'avenir Up Page Modèle achevé En 1911, Rutherford propose son modèle atomique: _L'atome offre des espaces vides immenses. _Le centre de l'atome, qu'il nomme "noyau" est minuscule et dense (grappe compacte). Il est chargé positivement. _Les électrons négatifs circulent autour du noyau à une très grande vitesse et se déplacent jusqu'à des distances très éloignées du noyau. Ces derniers sont retenus au noyau par des forces électriques. 
|
|
Les références Up Page Réseau Pepe Science & Vie Pourquoi ce site Je crois que, si les êtres humains que nous sommes ne parviennent pas toujours à évoluer comme ils le souhaiteraient _à s'épanouir professionnellement, sentimentalement et sexuellement (ce que j'appelle les trois pôles d'intérêts) c'est parce qu'il y a des barrages qui entravent leur désir d'accéder à un rêve inachevé. Je pars du principe que tout est possible, à condition de s'entourer de gens qui nous poussent à croire en nous. Contribuer au Réseau Pepe Ce site est avant tout une encyclopédie ouverte à l'imagination et au savoir, où chacun(e) d'entre vous peut participer. Si vous avez envie de partager une passion, ou si vous sentez le besoin de vous exprimer sur un point précis, je vous invite à m'adresser un e-mail (adresse électronique accessible sur ma page d'accueil). 
|
|
Mais encore … Up Page Ce que vous avez toujours voulu savoir  Analyse objective des faits Analyse objective des faits
 POINTS POSITIFS POINTS POSITIFS
 POINTS NEGATIFS POINTS NEGATIFS

|