Accueil Arborescence Page précédente

|
Effet paramagnétique
La petite histoire Comprendre simplement Domaines de présence Son interprétation dans l'avenir Les références Mais encore … |
|
by Pepe © Accueil Arborescence Page précédente |

|
|
La petite histoire Up Page Origine, raisons, hasard |
|
Comprendre simplement Up Page Fioles d'un certain nombre de composés (NaCl, MnSO4, FeSO4, CoCl2, NiSO4, ZnSO4, K4Fe(CN)6, [Co(NH3)6]Cl3, [Ni(NH3)6]Cl2, H2O) sont pendus d'un fil. Quand un aimant est apporté près, certaines des fioles sont attirées. Une règle est employée pour mesurer le débattement du fil de la verticale, qui se corrèle avec le nombre d'électrons dépareillés. NaCl Quand un échantillon de chlorure de sodium est apporté près des pôles de l'aimant, il n'y a aucune attraction du chlorure de sodium à l'aimant, même lorsque la fiole heurte l'aimant. Il n'y a aucun électron dépareillé en chlorure de sodium et le chlorure de sodium est diamagnétique. 


MnSO4 Le monohydrate de sulfate de Manganese(II) est fortement attiré par l'aimant, qui prouve qu'il est paramagnétique. Les ions de manganèse en monohydrate de sulfate de manganese(II) ont cinq électrons dépareillés. 




FeSO4 Le pentahydrate de sulfate fer (II) peut être apporté plus près de l'aimant que le monohydrate de sulfate de manganèse(II), mais par la suite il balance vers l'aimant. Ce composé n'est pas aussi fortement paramagnétique que le sulfate de manganese(II). Les ions de fer (II) ont quatre électrons dépareillés. 




Fe3SO4 champ magnétique Une équipe de chercheurs de l'University of California a Riverside a réussi à contrôler la couleur réfléchie par une solution contenant des particules en suspension dans de l'eau en appliquant un champ magnétique externe. Les particules utilisées ont un diamètre homogène d'environ 120 nm, elles sont constituées d'un auto assemblage tridimensionnel de nanoparticules d'oxyde de fer (Fe3SO4) d'un diamètre de 10 nm qui sont superparamagnétiques, c'est-à-dire qu'elles deviennent magnétiques seulement en présence d'un champ magnétique et ne possèdent pas d'aimantation rémanente comme les nanoparticules ferromagnétiques. Les nanoparticules sont recouvertes d'un polymère qui les maintient agrégées pour former ainsi un assemblage colloïdal assimilable à un cristal photonique qui réfléchit une longueur d'onde différente suivant le pas du réseau, lequel est défini ici par la distance entre chaque nanoparticule : en ajustant la valeur du champ magnétique appliqué, on modifie ce pas et on induit ainsi un changement de couleur de l'ensemble. Les scientifiques ont mesuré le spectre réfléchi par la solution en faisant varier le champ magnétique en modifiant la distance entre la solution et un aimant de NdFeB. Ils observent que la longueur d'onde du pic de réflexion se décale de 730 à 450 nm pour des valeurs du champ magnétique variant de 88 à 352 G. Il s'avère également que la durée de la transition induite par un changement d'intensité du champ est assez rapide (quelques centaine de millisecondes) : on peut ainsi penser que ce type de système pourrait être adapté à la fabrication d'écrans de grandes dimensions dont les pixels seraient formés par des particules contrôlées indépendamment par un champ magnétique; un tel écran ne nécessiterait alors aucune source de lumière interne puisque la lumière émise par l'écran serait en fait la lumière ambiante réfléchie par les cristaux photoniques. CoCl2 Le hexahydrate de chlorure de Cobalt(II) peut être apporté plus près des poteaux que le sulfate du fer (ii) ou le sulfate de manganese(II) avant qu'il balance vers l'aimant. Les ions de Cobalt(II) ont trois électrons dépareillés. 




NiSO4 Quand le hexahydrate de sulfate de nickel(II) est apporté près des pôles de l'aimant, il semble avoir l'attraction à peu près identique comme chlorure de cobalt(II), peut-être légèrement moins. Les ions de Nickel(II) ont deux électrons dépareillés. 




ZnSO4 Le heptahydrate de sulfate de Zinc(II) est apporté près des pôles de l'aimant. Comme dans le cas du chlorure de sodium, il n'y a aucune attraction entre le sulfate de zinc et l'aimant. Le degré de paramagnétisme de ces composés des métaux de transition peut être corrélé avec le nombre d'électro dépareillé en leurs ions en métal. 


K4Fe(CN)6 Un échantillon de hexacyanoferrate(II) de potassium s'avère diamagnétique. Les orbitales de d dans les ions d'iron(II) sont dédoublées par le champ en cristal fort des ligands de cyanure, permettant à chacun des six électrons d'appareiller. 


[Co(NH3)6]Cl3 Le chlorure de Hexaamminecobalt(III) n'est pas attiré aux pôles de l'aimant. Comme dans le cas de l'ion de hexacyanoferrate(II), le champ fort des ligands d'ammoniaque dédouble les orbitales de d et permet à tous les électrons d'appareiller. 


[Ni(NH3)6]Cl2 Le chlorure de Hexaamminenickel(II) est attiré faiblement aux pôles de l'aimant. Il a deux électrons dépareillés. 




H2O Un échantillon de l'eau liquide est examiné et il n'est pas attiré aux poteaux d'aimant ; l'eau est diamagnétique. 


|
|
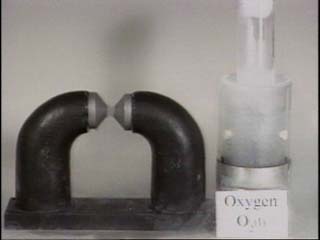
Domaines de présence Up Page Azote liquide et oxygène 
Un aimant est montré pour attirer fortement une paire de pinces en métal. L'aimant n'a aucun effet évident sur l'azote liquide, mais quand l'oxygène liquide bleu-clair est versée près des pôles de l'aimant, il montre l'attraction définie. Azote liquide Quand l'azote liquide sans couleur est versé entre les pôles de l'aimant, l'azote liquide ne colle pas aux poteaux d'aimant. 




Oxygène Quand l'oxygène liquide bleu-clair est employée, cependant, on observe un comportement différent. L'oxygène colle entre les pôles de l'aimant jusqu'à ce qu'il se vaporise loin, prouvant que l'oxygène liquide est paramagnétique, alors que l'azote liquide n'était pas. 



|
|
Son interprétation dans l'avenir Up Page Les états d'oxydation du manganèse L'oxyde de Manganèse(III), avec 4 électrons dépareillés par atome de manganèse, plus fortement est attiré à un aimant qu'est l'oxyde de manganèse(IV), avec seulement 3 électrons dépareillés par atome de manganèse. Le permanganate de potassium, un composé de Mn(VII), n'a aucun électron dépareillé et n'est pas attiré par un aimant. Mn2O3 L'oxyde du manganèse (iii) est paramagnétique avec 4 électrons dépareillés. 



MnO2 L'oxyde de Manganese(IV) est moins paramagnétique, avec seulement 3 électrons dépareillés. 



KMnO4 Le permanganate de potassium est diamagnétique sans les électrons dépareillés. 



Les substances contenant les électrons dépareillés sont habituellement paramagnétiques. En présence d'un champ magnétique les rotations des électrons dépareillés sont alignées et la substance est attirée par le champ magnétique. Mn2O3 a une configuration élevée d'électron de la rotation d4, il plus fortement est attiré par l'aimant que MnO2, avec une configuration d'électron de d3. Puisque MnO2- contient Mn(VII) avec une configuration de d0, il est diamagnétique (aucuns électrons dépareillés). Des substances diamagnétiques sont faiblement repoussées par un champ magnétique, mais l'effet est trop petit pour être observé sans aimant beaucoup plus fort que celui utilisé ici. |
|
Les références Up Page Réseau Pepe BE Etats-Unis Pourquoi ce site Je crois que, si les êtres humains que nous sommes ne parviennent pas toujours à évoluer comme ils le souhaiteraient _à s'épanouir professionnellement, sentimentalement et sexuellement (ce que j'appelle les trois pôles d'intérêts) c'est parce qu'il y a des barrages qui entravent leur désir d'accéder à un rêve inachevé. Je pars du principe que tout est possible, à condition de s'entourer de gens qui nous poussent à croire en nous. Contribuer au Réseau Pepe Ce site est avant tout une encyclopédie ouverte à l'imagination et au savoir, où chacun(e) d'entre vous peut participer. Si vous avez envie de partager une passion, ou si vous sentez le besoin de vous exprimer sur un point précis, je vous invite à m'adresser un e-mail (adresse électronique accessible sur ma page d'accueil). |
|
Mais encore … Up Page Ce que vous avez toujours voulu savoir |